El control biológico encuentra en la genética un aliado en su lucha contra la bacteria Xylella fastidiosa
Artículo Técnico elaborado por E. Lantero1, B. Matallanas1, S. Pascual2, C. Callejas1, publicado en la revista Anuario ECA OLIVE 2020.
La enfermedad causada por la bacteria Xylella fastidiosa fue descrita en viñedos californianos en 1891 por el botánico y patólogo Newton Pierce. Las diferentes rutas comerciales propiciaron su expansión, primero a Brasil y a otros países del sur del continente americano; más recientemente, las exportaciones de café de Costa Rica y el comercio global la han introducido en Europa, donde se notificó el primer brote en 2013, en olivares de Apulia, en el sur de Italia. A este brote le sucedieron otros en Córcega, la Riviera Francesa y finalmente en España, primero en Baleares en 2016, después en Alicante en 2017 y en 2018 se detectó en un olivo al sur de Madrid.
Esta bacteria es capaz de infectar almendros, olivos y otras 593 especies de plantas (EFSA 2020). Se multiplica en el interior de la planta, en el xilema, donde causa obstrucciones que impiden la circulación de la savia bruta. Como consecuencia, aparecen signos de marchitez o seca de hojas y ramas y en los casos más agudos, ocasiona la muerte de la planta.
La transmisión natural de X. fastidiosa de unas plantas a otras se produce por insectos vectores fitófagos, que se nutren del xilema de las plantas gracias a su característico aparato bucal picador-chupador. Cuando se alimentan del xilema de una planta infectada, arrastran la bacteria, transportándola en su aparato bucal y la transfieren al interior de otra planta al alimentarse de ella. Los insectos vectores intervienen por tanto como transmisores de la enfermedad y son principalmente hemípteros de los grupos cicadélidos y cercópidos. Actualmente hay dos especies transmisoras confirmadas en Europa: ‘las cigarrillas’ Neophilaenus campestris y Philaenus spumarius (Figura 1).
Por la rápida expansión de X. fastidiosa en Europa y las pérdidas económicas que puede ocasionar, la aparición de síntomas en una planta conlleva el empleo de medidas drásticas para evitar la propagación de la bacteria y facilitar su erradicación. La principal ha sido arrancar los olivos y plantas infectadas -todas- en cien metros a la redonda además de eliminar cualquier material vegetal susceptible de ser infectado para crear una zona tampón alrededor. En segundo lugar, aplicar tratamientos fitosanitarios en el radio de la zona afectada. Estas severas medidas evidencian la necesidad de impulsar medidas preventivas que se apoyen en una gestión adecuada de los cultivos con buenas prácticas agrarias, así como en el control de las poblaciones de los insectos vectores. Durán y colaboradores (Phytoma España, nº 304, Dic. 2018), señalan que las medidas de control se centran en el manejo de la vegetación herbácea durante el periodo de presencia de ninfas (etapas juveniles) de los insectos vectores y en el control de los adultos en sus primeros momentos mediante insecticidas en la vegetación herbácea, antes de que pasen a alimentarse de árboles y arbustos.
Son conocidos los efectos secundarios de los productos insecticidas, pues también afectan a la fauna beneficiosa del agro-ecosistema disminuyendo su biodiversidad, además de potenciar el incremento de poblaciones de insectos resistentes. Para racionalizar el uso de fitosanitarios, la UE (Directiva 2009/128/CE) y el Gobierno de España (RD 1311/2012, BOE-A-2012-11605) contemplan, entre otras alternativas, el control biológico mediante enemigos naturales. Con el fin de determinar las posibles especies que depredan a la ‘cigarrilla’ P. spumarius, vector de X. fastidiosa, una buena aproximación es estudiar el contenido gástrico de los artrópodos del ecosistema agrario. Pero averiguar qué han devorado los depredadores analizando los restos encontrados en su tracto digestivo resulta muy complicado, dado el minúsculo tamaño del depredador y de la presa.
Y en este contexto se ha centrado una de nuestras líneas de trabajo aplicando herramientas moleculares, cuyos avances en las últimas décadas ayudan a resolver cuestiones de diversa índole en diferentes áreas. En este caso, para detectar si en el contenido gástrico de los potenciales depredadores del agro-ecosistema se hallan restos de ADN de P. spumarius. Para ello, se ha utilizado la reacción en cadena de la polimerasa (PCR), técnica que permite amplificar de manera específica un fragmento concreto del ADN de la cigarrilla, gracias al diseño y empleo de unas pequeñas moléculas de ADN totalmente complementarias al ADN de la cigarrilla (como una llave con su cerradura). De este modo, si en el aparato digestivo de un artrópodo depredador hay restos de ADN de P. spumarius, aunque sean cantidades mínimas, la PCR genera millones de copias de ese fragmento concreto de ADN que facilitan su detección y, por tanto, confirmar la depredación.
La herramienta fue testada en el laboratorio, determinándose que tenía una elevada sensibilidad, pues detecta cantidades ínfimas de ADN de P. spumarius, en concreto 2.5 picogramos de ADN (un picogramo corresponde a la billonésima parte de un gramo), y gran especificidad, sólo detecta ADN de P. spumarius y no de cualquier otra especie de la fauna de ese ecosistema agrario.
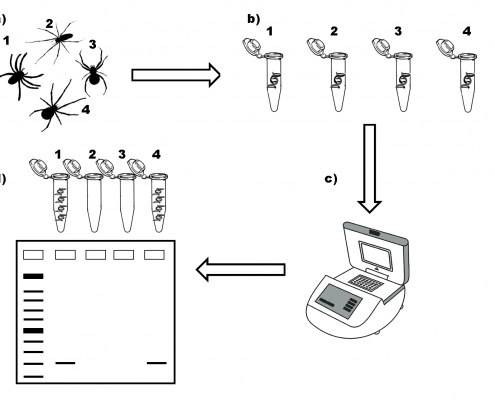
Seguidamente se evaluó su utilidad en condiciones reales, en olivares del sur de Madrid en primavera, cuando emergen los adultos de los insectos vectores. La Figura 2 esquematiza el abordaje seguido. En un estudio previo en esos olivares del sur de la Comunidad de Madrid observamos la abundancia y eficacia de las arañas como grupo depredador de la mosca del olivo. Por tanto, se realizó una primera evaluación de la técnica en 63 arañas capturadas. Se detectó la presencia de ADN de P.spumarius en el tracto digestivo del 6.35% de las arañas capturadas, indicativo de que habían ingerido ‘cigarrillas’ al menos en las últimas horas. El resultado pone de manifiesto la validez y utilidad de esta herramienta molecular en estudios de control biológico de P. spumarius mediado por potenciales depredadores presentes en los agro-ecosistemas. Esta técnica es fiable y extrapolable al análisis de otros depredadores de P. spumarius, el principal vector de la bacteria Xylella fastidiosa, en los diferentes cultivos a los que infecta.

Figura 3. La biodiversidad del propio olivar puede proporcionar un beneficio frente a las plagas gracias a la presencia de enemigos naturales.
Nuestra aproximación molecular evidencia la necesidad de invertir en ciencia para luchar contra plagas y enfermedades agrarias que causan graves daños económicos a lo largo de todo el proceso de producción. Asimismo, se pone de manifiesto la importancia de la biodiversidad del propio agro-ecosistema frente a las plagas (Figura 3). Habría que tener en cuenta buenas prácticas agrícolas para favorecer la presencia de estos animales, enemigos naturales, que proporcionan un beneficio ecosistémico ambientalmente respetuoso.
Figura 1. Ninfa de P. spumarius en las características “espumas”, fotografiada en la flora circundante de un olivar en el sur de la Comunidad de Madrid.
Figura 2. Abordaje seguido para el análisis molecular de la depredación en campo.
a.- Obtención de arañas adultas en campo.
b.- Extracción del ADN de cada araña en el laboratorio.
c.- Reacción en Cadena de la Polimerasa (PCR) de un fragmento concreto de ADN de P. spumarius. Mediante la PCR, ese fragmento es amplificado exponencialmente para obtener muchas copias del mismo. Se realiza en un termociclador, donde varía la temperatura en función de las distintas etapas de las reacciones de amplificación.
d.- Tras la PCR se visualizan los resultados obtenidos mediante electroforesis (técnica que utiliza corriente eléctrica para mover las moléculas de ADN y que se separen en un soporte gelatinoso). En las muestras 1 y 4, las múltiples copias de ADN obtenidas se observan en forma de banda. Por tanto, las arañas 1 y 4 han ingerido ejemplares de ‘cigarilla’ en las horas previas a su captura.
1 Unidad Docente de Genética, Fac. de CC Biológicas, Universidad Complutense, 28040 Madrid.
2 Dpto. Protección Vegetal, Grupo de Entomología, INIA, Crta. A Coruña Km 7,5, 28040 Madrid.